益普生2024年前三季度实现强劲的销售势头并上调2024年全年指引
全球特药领域生物制药公司益普生(Euronext:IPN;ADR:IPSEY)于近日公布了2024年前三季度及2024年第三季度的业绩。
要闻
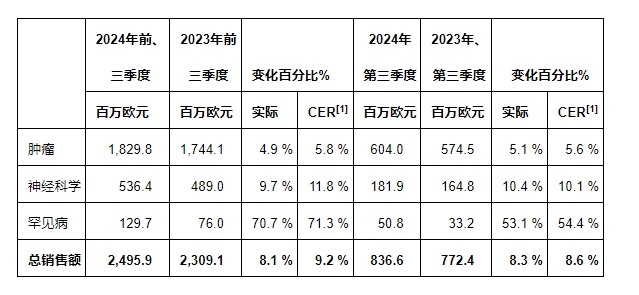
• 以固定汇率[1]计算,2024年前三季度的总销售额增长率为9.2%(报告数据为8.1%),该增长主要归因于以下三个方面:吉适®(AbobotulinumtoxinA)、Cabometyx®(Cabozantinib)和Bylvay®(Odevixibat)业绩增长显著,索马杜林®(兰瑞肽)销售额稳健增长,以及在2L PBC[2]领域推出的Iqirvo®(Elafibranor)和在1L mPDAC[3]领域推出的Onivyde®(伊立替康)也贡献巨大
• Iqirvo和Kayfanda®(Odevixibat)在欧盟获得监管批准
• 上调2024年财务指引:以固定汇率[1]计算的总销售额增长超过8.0%(前期指引:以固定汇率[1]计算超过7.0%);核心营业利润率高于总销售额的31.0%(前期指引:高于30.0%)
首席执行官David Loew表示:"自2020年我们的战略启动以来,我们实现了持续增长。本季度也不例外,同时研发管线也取得进一步进展。我们还继续推出多种适应症和治疗线,包括最近上市的Iqirvo和Onivyde,均进展顺利。在今年前三季度业绩的支持下,我们将进一步上调2024年的销售额和利润指引。
我们已创立良好的交付记录,而外部创新、商业卓越和我们持续为患者提供更多选择的使命为此奠定了坚实基础。"
2024年全年指引
基于第三季度的强劲业绩,益普生已进一步上调2024年的财务指引:
• 按固定汇率计算,总销售额增长率超过8.0%(前期指引:超过7.0%)。基于2024年9月的平均汇率水平,预计汇率将对总销售额产生约1.5%的不利影响
• 核心营业利润率高于总销售额的31.0%(前期指引:高于30.0%)
研发管线更新
2024年9月,Iqirvo 80 mg片剂获得了欧盟委员会的附条件批准,用于与熊去氧胆酸(UDCA)联合治疗对UDCA应答不足的成人患者的PBC,或在无法耐受UDCA的患者中用作单药治疗。2024年6月,Iqirvo在相同背景下获得了美国FDA的批准。
2024年9月,欧盟委员会还批准Kayfanda用于治疗Alagille综合征(ALGS)六月龄患儿的瘙痒。Odevixibat(商品名为Bylvay)已获批上市,在欧盟用于治疗进行性家族性肝内胆汁淤积(PFIC),在美国和欧盟用于治疗PFIC,在美国用于治疗ALGS。
同月,CABINET Ⅲ期试验的最终结果在2024年欧洲肿瘤内科学会大会上公布,并于《新英格兰医学期刊》上发表,进一步证实了Cabometyx治疗晚期神经内分泌肿瘤的疗效获益。当时,益普生宣布已向欧洲药品管理局提交上市许可的新增适应症申请。
业务发展
2024年8月,益普生签订协议,出售其罕见儿科疾病优先审评券。作为协议的一部分,益普生在第三季度收到1.58亿美元的现金支付。
2024年10月,Eton Pharmaceuticals与益普生达成协议,收购Increlex®(Mecasermin注射液)。预计该交易将于2024年年底前完成。
与Galderma的仲裁程序
截至2024年9月30日,Galderma在国际商会(ICC)对益普生发起的两次仲裁程序正在进行中。第一个争议由Galderma于2021年发起,涉及根据2007年在欧盟、某些东欧国家和中亚签署的协议中与Azzalure®(AbobotulinumtoxinA)和吉适相关的商业伙伴关系的地域范围。ICC内部仲裁庭于2024年10月发布最终裁决,驳回Galderma在第一次仲裁中的大部分(如果不是全部)索赔,并要求Galderma承担益普生产生的大部分法律费用和仲裁费用。
第二个争议由Galderma于2023年11月发起,涉及益普生2023年终止双方于2014年根据各自的早期神经毒素项目(包括IPN10200开发)签订的联合研发合作协议的有效性。在现阶段,益普生无法合理预测这一最终剩余仲裁程序的任何潜在财务影响,益普生打算充分捍卫和维护其权利。
说明
所有财务数据均以百万欧元(€m)为单位。本报告的业绩涵盖2024年9月30日之前的9个月(2024年前三季度)和2024年9月30日之前的3个月(2024年第三季度),而进行数据对比的对象为2023年9月30日之前的9个月(2023年前三季度)和2023年9月30日之前的3个月(2023年第三季度)。除非另有说明,否则评论基于2024年前三季度的业绩。
关于益普生
益普生是一家全球性的生物制药公司,专注于在肿瘤、罕见病和神经科学三个治疗领域为患者提供革新型药物。我们的研发管线以外部创新为动力,有近百年的开发经验以及美国、法国、英国的全球中心作为有力的支持。分布于40多个国家的全球团队,共同与我们在世界各地的合作伙伴关系,使我们为100多个国家的患者提供药物。
益普生在巴黎(泛欧交易所:IPN)上市并通过赞助的I级美国存托凭证项目(ADR:IPSEY)在美国上市交易。有关益普生的更多信息,请访问 ipsen.com.
关于益普生中国
益普生集团于1992年进入中国,2019年在上海设立创新中心,是全球四个研发中心之一。益普生于2021年在上海成立中国区总部,并于2022年根据集团业务变动,同步剥离多元健康业务,专注于特药领域,针对三大疾病领域(肿瘤、罕见病、神经科学)携手上海创新中心持续推出创新治疗方案以满足中国患者亟待解决的治疗需求。
益普生-有关前瞻性声明的警示说明
本文所含前瞻性声明、目的和目标基于集团的管理战略、当前观点和假设。此类声明涉及已知和未知的风险和不确定性,可能导致实际结果、业绩或事件与本文所预期的大不相同。上述所有风险均可能影响集团在未来实现其财务目标的能力,财务目标是基于现今可用信息在合理的宏观经济条件下设定的。"相信"、"期望"和"期待"等词语和类似表述的使用是为了明确前瞻性声明,包括集团对未来事件的期望,此类事件包括监管文件和决定。此外,本文所述目标的制定未考虑外部增长假设和潜在未来收购,而这两者可能会使指标发生变化。目的的依据是集团认为合理的数据和假设。目标取决于将来可能发生的条件或事实,而不仅取决于历史数据。考虑到某些风险和不确定性的发生,实际结果可能与这些指标有很大出入,明显表现为在早期研发阶段或临床试验中有前景的产品可能最终永远不会投放市场或达到其商业目标,尤其是由于注册或竞争原因。集团必须面对或可能面对来自仿制药的竞争,这可能会转化为市场份额的损失。此外,研发过程涉及多个阶段,每个阶段都涉及重大风险,即集团可能无法实现其目的并被迫放弃就自身已投入大量资金的产品所做的努力。因此,集团不能确定在临床前试验中获得的有利结果是否会在随后的临床试验中得到确认,也不能确定临床试验的结果是否足以证明相关产品的安全性和有效性。不能保证产品将获得必要的注册批准或该产品将被证明在商业上是成功的。如果基本假设证明不准确或确实出现风险或不确定性,则实际结果可能与前瞻性声明中的结果有很大不同。其他风险和不确定性包括但不限于一般行业条件和竞争;一般经济因素,包括利率和货币汇率波动;制药行业法规和医疗保健立法的影响;全球医疗成本抑制趋势;竞争对手获得技术进步、新产品和专利;新产品研发中固有的挑战,包括获得监管部门的批准;集团准确预测未来市场状况的能力;生产困难或延误;国际经济的金融不稳定和主权风险;对集团专利的有效性和创新产品的其他保护的依赖;以及可能面临的诉讼,包括专利诉讼和/或监管诉讼。此外,集团依赖第三方来研发和销售某些产品,这些产品可能会产生大额特许权使用费用;这些合作伙伴的行为可能会对集团的活动和财务结果造成损害。集团不能确定其合作伙伴将履行各自的义务。集团可能无法从这些协议中获得任何利益。集团任何合作伙伴违约均会产生低于预期的收益。此类情况可能会对集团的业务、财务状况或业绩产生负面影响。集团明确声明,除非适用法律有所要求,否则其不承担更新或修订本新闻稿中所包含的任何前瞻性声明、目标或假设的任何义务,以反映此类声明所依据的事件、条件、假设或情况的任何变化,也不会就此作出任何承诺。集团的业务受制于其在法国金融市场监管机构备案的注册文件中概述的风险因素。该文件中所列风险和不确定性并非详尽无遗,建议读者参阅集团网站(www.ipsen.com)上集团的最新通用注册文件。
[1]以固定汇率(CER)计算,即通过应用前一时期使用的汇率重新计算相关时期的业绩,排除任何外汇影响。
[2]原发性胆汁性胆管炎二线治疗。
[3]转移性胰腺导管腺癌一线治疗。